
세계보건기구(WHO) 산하 국제암연구소(IARC)의 세계 암보고서 ′Globocan: 2020’에 따르면 위암은 전 세계에서 다섯 번째로 흔히 발생하는 암종으로, 전체 발생 암의 5.6%를 차지하고 있습니다.
모든 위암 환자 중 60%는 동아시아에서 관찰되었으며, 그중 43.9%는 중국에서 관찰되었습니다. 그러나 현재까지 유방암, 대장암과는 달리 위암 분야에서는 수술 후(D2 dissection) 예후 예측이 가능한 분자 진단 제품이 개발되지 않았습니다.
당사는 위암 수술 후 예후를 예측할 수 있는 분자 진단키트를 세계 최초로 개발해 2017년 식품의약품안전처로부터 품목허가를 받았습니다. 이후 신의료 기술평가 절차 중 2019년 새로 도입된 ‘혁신 의료기술 별도평가트랙’을 통해 기술의 잠재성을 인정받아 정부의 제1호 혁신 의료기술에 선정됐습니다.
nProfiler® 1 Stomach Cancer Assay는 2~3기 진행성 위암환자를 대상으로 하며, 수술을 통해 적출한 포르말린 고정 파라핀 포매 검체(FFPE)를 이용해 위암 표적 유전자 (GZMB, WARS, SFRP4, CDX1)의 발현량을 실시간 역전사 중합효소연쇄반응으로 측정합니다. 이후 자체 개발한 알고리즘의 분석을 통해 위암 환자의 5년 생존율을 예측∙ 평가합니다.
nProfiler® 1 Stomach Cancer Assay
The First Molecular IVD for Stomach Cancer Assay Kit
in the World
 작용원리
작용원리




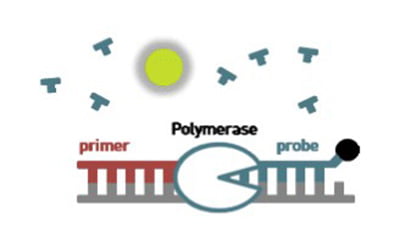










본 기술의 알고리즘은 위암 환자의 수술 후 예후를 저위험군, 중위험군, 고위험군으로 구분해 주는 예후예측 분류 알고리즘 (Single Patient Classifier-prognosis; SPC-prognosis)과
항암생존편익 여부를 구분(항암생존편익군, 항암생존비편익군) 해 주는 항암생존편익 예측 분류 알고리즘(Single Patient Classifier-prediction; SPC-prediction)으로 구성됩니다.
본 위암 예후예측 유전자 분자진단 검사의 목적은 임상의가 위암 수술 환자를 진단하고 진료주기 및 치료방법 등을 결정하는데 참고할 수 있도록 정보를 제공하는 데 있습니다.
이를 통해 환자는 과잉 또는 과소 치료의 가능성을 줄이고 각 상태에 따라 치료를 받을 수 있습니다.
본 기술은 현행 위암의 항암표준치료가 된 CLASSIC 연구(제 3상 전향적 다기관 무작위배정 임상시험 코호트, The Lancet 2014; Volume 15: 1389-96)에서 사용된 보관샘플로 유효성 및 유용성을 검증하였으며,
그 결과가 2018년 5월 Lancet Oncology (2018. Impact Factor; 35.386)에 게재되었습니다.
이 결과는 위암 치료 전략 수립 최적화에 기여해 궁극적으로 개별 환자에 대한 정밀의학의 실현을 도모할 수 있을 것으로 기대됩니다.
| NO. | 항목 | 내용 | NO. | 항목 | 내용 |
|---|---|---|---|---|---|
| 01 | 품목군 | 종양관련 유전자 검사시약 | 02 | 제품명 | nProfiler® 1 Stomach Cancer Assay |
| 03 | 모델명 | NP1T05: 5인 테스트 NP1T15: 15인 테스트 |
04 | 분류번호(등급) | N02030.01 (3등급) |
| 05 | 검사대상 | 진행성 위암 (2~3기, AJCC 8판기준) 환자 | 06 | 포장단위 | 5인 테스트/Kit, 15인 테스트/Kit |
| 07 | 저장방법 | -20℃ | 08 | 사용기한 | 제조일로부터 6개월 |
| 09 | S/W 프로그램 | nDx 1 소프트웨어 | 10 | 사용목적 | FFPE 조직 샘플에서 9개 유전자의 발현량을 RT-qPCR 방법으로 측정하고 알고리즘을 사용하여 환자의 예후에 따라 3개의 군(Low, Intermediate, High risk)으로 구분함. |
| NO. | 항목 | 내용 |
|---|---|---|
| 01 | 품목군 | 종양관련 유전자 검사시약 |
| 02 | 제품명 | nProfiler® 1 Stomach Cancer Assay |
| 03 | 모델명 | NP1T05: 5인 테스트 NP1T15: 15인 테스트 |
| 04 | 분류번호(등급) | N02030.01 (3등급) |
| 05 | 검사대상 | 진행성 위암 (2~3기, AJCC 8판기준) 환자 |
| 06 | 포장단위 | 5인 테스트/Kit, 15인 테스트/Kit |
| 07 | 저장방법 | -20℃ |
| 08 | 사용기한 | 제조일로부터 6개월 |
| 09 | S/W 프로그램 | nDx 1 소프트웨어 |
| 10 | 사용목적 | FFPE 조직 샘플에서 9개 유전자의 발현량을 RT-qPCR 방법으로 측정하고 알고리즘을 사용하여 환자의 예후에 따라 3개의 군(Low, Intermediate, High risk)으로 구분함. |
※ 본 검사는 Cheong, et al. Lancet Oncol 2018;19 에 기술된 바와 같이 검사의 성능이 Low / Intermediate / High Risk의
5년 생존율 83.2%, 74.8%, 66.0% 로 검사 결과가 갖는 임상적 의미가 일부 증명되었습니다.
그러나 본 검사는 임상적 유효성에 대한 추적 연구가 필요한 검사입니다.